En una sala blanca del Hospital Universitario de Osaka, cuatro personas se sientan frente a un equipo médico que les habla con una mezcla de esperanza y prudencia. Todos han perdido buena parte de la visión. En sus córneas, la superficie transparente que cubre el ojo, el tejido se ha vuelto opaco y rugoso. Cada parpadeo duele. Cada destello de luz se dispersa en un velo de niebla. No hay trasplante convencional que sirva. Pero hay algo nuevo.
Les proponen un injerto hecho no de tejido donado, sino de células madre pluripotentes inducidas, las célebres iPSC descubiertas en Japón hace casi dos décadas. Es el primer ensayo en humanos de este tipo. Nadie puede garantizar el resultado. Y, sin embargo, todos aceptan.
Casi un año después, los cuatro pacientes pueden ver mejor. La transparencia de la córnea ha vuelto en distintos grados, el dolor ha cedido, y uno de ellos ha pronunciado una frase que quedará grabada en la historia clínica: «Puedo leer los letreros de la calle».
El origen de una revolución celular
Para entender por qué este avance es tan significativo hay que retroceder a 2006, cuando un investigador japonés, Shinya Yamanaka, anunció algo que parecía imposible: había logrado reprogramar células adultas para devolverlas a un estado pluripotente, capaz de generar cualquier tejido del cuerpo. Sin embriones, sin las disputas éticas que habían frenado a la biología regenerativa. Solo con un puñado de genes.
Su hallazgo, publicado en Cell, cambió el curso de la medicina moderna. Por primera vez, la humanidad podía pensar en crear tejidos a medida: piel, neuronas, músculo o retina, a partir de sus propias células. En 2012, Yamanaka recibiría el Nobel, y Japón se convertiría en el epicentro de esta nueva biología.
El primer ensayo clínico con iPSC llegó en 2014, también en Japón. La oftalmóloga Masayo Takahashi, del instituto RIKEN, utilizó células iPSC autólogas —creadas a partir de la propia piel de una paciente— para fabricar epitelio pigmentario de retina (RPE). El objetivo: tratar una forma avanzada de degeneración macular. La operación fue un éxito técnico y simbólico. No solo no aparecieron tumores ni rechazos, sino que el injerto se mantuvo estable durante años. Por primera vez, un tejido generado en laboratorio sobrevivía dentro del cuerpo humano.
Aquel paso abrió un camino, y la mirada de la ciencia se desplazó lentamente desde la retina hacia otra frontera ocular: la córnea.
La córnea: cuando el borde del ojo se apaga
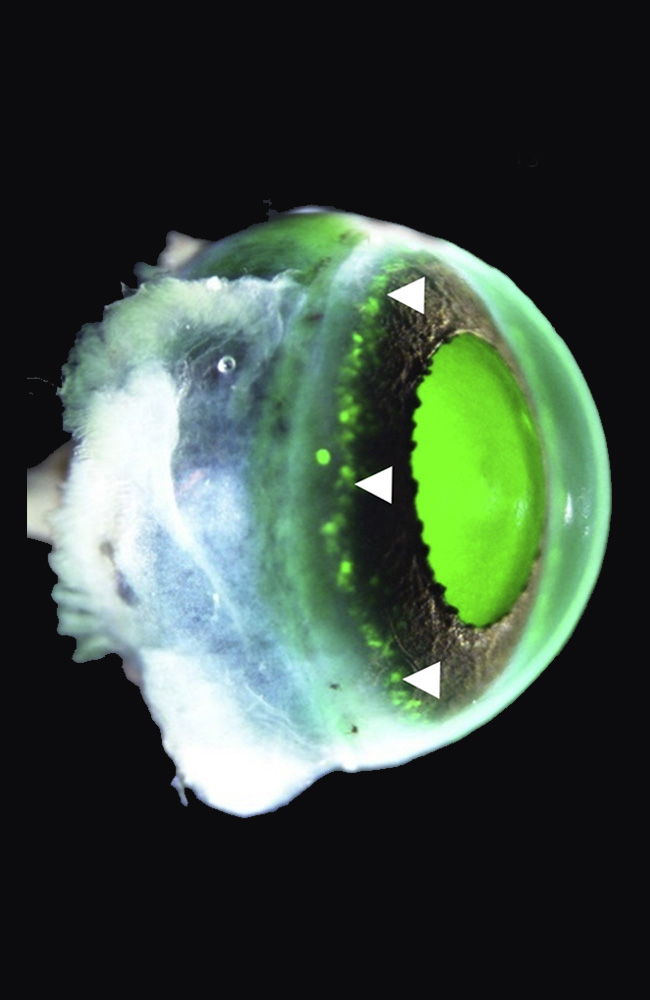
La córnea no es solo una ventana transparente. Es una lente viva que se renueva constantemente gracias a un pequeño grupo de células madre situadas en su perímetro, el llamado limbo corneal. Cuando esas células se pierden —por quemaduras, infecciones o enfermedades congénitas—, la superficie del ojo se cubre de vasos sanguíneos y tejido opaco. Es lo que se conoce como deficiencia de células madre limbares (LSCD).
Durante años, las soluciones fueron parciales. Se probó el trasplante de limbo del ojo sano (CLET), el uso de fragmentos autólogos cultivados en laboratorio (SLET) o injertos de mucosa oral (COMET). Todos compartían el mismo problema: requerían tejido donante, implicaban inmunosupresión y no siempre garantizaban la recuperación visual.
El sueño era más ambicioso: crear una córnea funcional desde cero, usando células reprogramadas.
El salto de Osaka
En 2024, el equipo del oftalmólogo Koji Nishida en la Universidad de Osaka anunció en The Lancet el primer ensayo clínico con láminas de epitelio corneal derivadas de iPSC alogénicas. Cuatro pacientes, cuatro ojos. La intervención consistía en trasplantar una capa de células corneales generadas a partir de un banco de iPSC compatibles con el sistema inmunitario de cada receptor.
El procedimiento era delicado. Las láminas, finas como un pétalo, se colocaban sobre la córnea dañada tras eliminar el tejido enfermo. A partir de ahí, el éxito dependía de la integración del nuevo epitelio, de su capacidad para mantenerse transparente y de no provocar rechazo.
Los resultados fueron tan sorprendentes como prudentes. En los cuatro pacientes, la superficie se reconstruyó de forma estable. La opacidad disminuyó, la inflamación se redujo y la agudeza visual mejoró. En uno de los casos, el efecto se mantuvo solo parcialmente al cabo de un año, lo que subraya la necesidad de seguimiento. Pero la seguridad del procedimiento quedó demostrada: ningún evento adverso grave, ninguna proliferación anómala, ningún tumor.
Por primera vez, la visión perdida comenzaba a regresar gracias a células que, en otro tiempo, fueron piel.
De la piel al ojo: una sinfonía celular
El proceso de fabricar un tejido ocular a partir de iPSC es una obra de precisión. Primero, se reprograman células somáticas —habitualmente de la piel— introduciendo una combinación de genes (los llamados «factores de Yamanaka») que las devuelven a su estado embrionario. Luego, mediante señales químicas y ambientales, se guían hacia un linaje concreto: en este caso, el epitelio corneal.
El resultado es una lámina de células vivas que, una vez implantada, se adhiere al estroma de la córnea y comienza a funcionar como barrera transparente y protectora. Es un proceso que combina biología molecular, ingeniería de tejidos y cirugía reconstructiva de alta precisión.
Detrás de su aparente sencillez —un injerto que devuelve la claridad a un ojo— hay quince años de desarrollo tecnológico y cientos de ensayos preclínicos en animales.
Una carrera de fondo
El éxito de Osaka no fue un salto repentino, sino el punto culminante de una carrera silenciosa. En los últimos años, Japón ha apostado por una estrategia nacional para acelerar las terapias con iPSC. Creó un banco de líneas celulares HLA compatibles, impulsó regulaciones flexibles y fomentó la colaboración entre universidades, hospitales y la Agencia Japonesa de Medicina Regenerativa.
Mientras tanto, en el resto del mundo, los avances se concentraban en modelos experimentales: reparación cardíaca, neuronas dopaminérgicas para Parkinson, hepatocitos para insuficiencia hepática. Pero el ojo seguía siendo el terreno más fértil. Su accesibilidad quirúrgica, su inmunoprivilegio parcial y su importancia funcional lo convirtieron en el laboratorio ideal para la regeneración humana.
Entre la promesa y la prudencia
Aun así, los desafíos no desaparecen. Los investigadores señalan que los injertos derivados de iPSC deben controlarse durante años para descartar mutaciones o transformaciones indeseadas. La cuestión del rechazo inmunitario sigue abierta, y los costes de producción siguen siendo elevados.
Por eso, el futuro pasa por bancos de células universales, con líneas iPSC modificadas genéticamente para reducir la respuesta inmunológica y ser compatibles con un amplio espectro de receptores. Ese es el siguiente paso en Osaka y en otros laboratorios: lograr tejidos listos para usar, seguros y accesibles.
De la retina a la córnea: un mismo horizonte
Lo ocurrido en Osaka no es un episodio aislado. Es el reflejo de una tendencia global: el ojo como frontera de la biología regenerativa.
Primero fue la retina, con Takahashi y su paciente de degeneración macular. Ahora es la córnea. Y en el horizonte se perfilan terapias híbridas que combinan células madre, biomateriales y nanotecnología para reconstruir estructuras oculares completas.
Cada avance suma una pieza a un mismo mosaico: el intento de la humanidad por reparar lo que el cuerpo no puede regenerar por sí mismo.
Lo que significa volver a ver
Más allá de la terminología científica —láminas epiteliales, HLA, pluripotencia—, este logro encierra algo profundamente humano: la posibilidad de recuperar la visión. No solo ver, sino volver a distinguir la forma de un rostro, la silueta de un árbol, el trazo de una letra.
Uno de los pacientes del ensayo lo resumió con una frase sencilla: «Puedo leer el nombre de mi calle».
No era una cura milagrosa. Era el resultado tangible de veinte años de ciencia, de un país que apostó por la investigación básica y de una disciplina que aprendió a convertir la piel en luz.
El futuro ya tiene ojos
Quizá dentro de unas décadas recordemos estos cuatro pacientes como el punto de inflexión en la historia de la medicina regenerativa. Igual que la penicilina o el primer trasplante de corazón, este injerto de células madre podría marcar el inicio de una nueva era.
La visión recuperada no pertenece solo a quienes participaron en el ensayo. Pertenece a toda una generación de investigadores que imaginaron que las células podían regresar al origen y, desde ahí, volver a construirnos.
La piel que ve, la ciencia que repara, la humanidad que insiste.
El futuro, literalmente, ya tiene ojos.


Deja tu comentario!